পরমাণু মডেল (Atom Model): ১৮৯৭–১৯৩২ খ্রিস্টাব্দ পর্যন্ত বিভিন্ন বিজ্ঞানী পরমাণুর ওপর বিভিন্ন পরীক্ষা-নিরীক্ষার পর প্রাপ্ত তথ্য থেকে পরমাণুর গঠন সম্বন্ধে যে যুক্তিনির্ভর মতবাদ উপস্থাপন করেন, তা পরমাণু মডেল নামে পরিচিত। এখানে বহুল আলোচিত-সমালোচিত প্রধান দুটি পরমাণু মডেল সম্বন্ধে আলােচনা করা হলাে:
(১) রাদারফোর্ডের পরমাণু মডেল (Rutherford’s Atom Model) : 1911 খ্রিস্টাব্দে উপস্থাপিত।
(২) বােরের পরমাণু মডেল। – (Bohr’s Atom Model) : 1913 খ্রিস্টাব্দে উপস্থাপিত।
রাদারফোর্ডের আলফা কণা বিচ্ছুরণ পরীক্ষা: নিউক্লিয়াস আবিষ্কার (Rutherford’s Alpha-Particle Scattering Experiment: Nucleus discovery)
ইলেকট্রন আবিষ্কারের পর পরমাণুর গঠন সম্পর্কে বিজ্ঞানী থমসন প্রস্তাবিত (1898 খ্রি:) plum-pudding পরমাণু মডেল সম্বন্ধে নিশ্চিত প্রমাণ লাভের উদ্দেশ্যে ১৯১১ খ্রিস্টাব্দে রাদারফোর্ড আলফা (0) কণা বিচ্ছুরণ পরীক্ষাটি করেন।
তাঁর পরীক্ষার কিছুদিন পূর্বেই আবিষ্কৃত হয় যে, রেডিয়াম (ssRa), ইউরেনিয়াম (opU) ইত্যাদি তেজস্ক্রিয় মৌল থেকে স্বতঃস্ফূর্তভাবে আলফা কণা বিকিরিত হয়। হিলিয়াম পরমাণু হতে দুটি ইলেকট্রন বের করে নিলে যে বিধনাত্মক হিলিয়াম নিউক্লিয়াস। অবশিষ্ট থাকে; তাকে ৫-কণা বলে।
অবশ্য -কণার প্রচণ্ড গতি থাকে। আলফা কণার গতি 1.0×10 হতে 2.5 x 107 পর্যন্ত হয়ে থাকে। এ-কণাতে দুটি প্রােটন ও দুটি নিউট্রন থাকে ()। তাই α-কণার ভর সংখ্যা হয় 4।
রাদারফোর্ডের পরীক্ষায় ব্যবহৃত উপকরণঃ
(১) তেজস্ক্রিয় মৌল থেকে নির্গত α-কণা
(২) পাতলা সােনার পাত (0.0004 cm পুরু)
(৩) জিঙ্ক সালফাইড (ZnS) আবরণযুক্ত পর্দা।
রাদারফোর্ডের পরীক্ষার বর্ণনা (Explanation of Rutherford’s Experiment)
বিজ্ঞানী রাদারফোর্ড প্রচণ্ড শক্তিসম্পন্ন দ্বিধনাত্মক চার্জযুক্ত আলফা কণাসমূহকে একটি পাতলা সােনার পাতের (0.0004 cm) ওপর টার্গেট বা নিক্ষেপ করেন।
সােনার পাতের চারদিকে ঘিরে জিঙ্ক সালফাইড (ZnS) আবরণযুক্ত একটি গােলাকার পর্দা রাখেন। ZnS আবরণীর ওপর পতিত α-কণা আলােকচ্ছটা সৃষ্টি করে।
[ZnS হলাে অনুপ্রভা সৃষ্টিকারী পদার্থ (Phosphorescent substance)। অনুপ্রভা সৃষ্টিকারী পদার্থ বিভিন্ন শক্তির photon শশাষণ করে পরে তা দৃশ্যমান আলাের পরিসরে বিকিরণ করে।
পর্যবেক্ষণ : তিনি লক্ষ করেন যে, (১) প্রায় 99% আলফা কণাই এ সােনার পাত ভেদ করে সােজাসুজি চলে যায় এবং Zns পর্দাকে আলােকচ্ছটায় দীপ্তিমান বা আলােকিত করে।
(২) তবে মাত্র কয়েকটি -কণা তাদের পথ থেকে বেঁকে পেছন দিকে চলে যায়।
(৩) খুব কম সংখ্যক আলফা কণা (প্রায় , ২০,০০০ এর মধ্যে ১টি) বিপরীত দিকে ফিরে আসে।
সিদ্ধান্ত : এ পরীক্ষা থেকে রাদারফোর্ড নিম্নোক্ত সিদ্ধান্ত গ্রহণ করেন :
(১) পরমাণুর অধিকাংশ স্থানই ফাঁকা। যেহেতু আলফা কণার তুলনায় ইলেকট্রনের ভর অতি নগণ্য,
সেহেতু এই ফাঁকা স্থানে ইলেকট্রন থাকতে পারে।
বিপরীতমুখী ও তবে এরা আলফা কণার গতিপথের কোনাে পরিবর্তন আলফা কণা ঘটাতে পারে না।
(২) যেহেতু খুব কমসংখ্যক α-কণা বিপরীত দিকে ফিরে আসে, এতে প্রমাণিত হয়, ঐ α-কণা রাদারফোর্ডের আলফা কণা বিচ্ছুরণ পরীক্ষা। সােজাসুজি এর অপেক্ষা বহু ভারী কোনাে কিছুর সাথে সংঘর্ষে পতিত হয় বা তা দ্বারা বিকর্ষিত হয়। অর্থাৎ পরমাণুর কেন্দ্রে পরমাণুর প্রায় সমগ্র ভর (পরমাণুর
ভরের 99.97% ভর) অতি ক্ষুদ্র স্থান দখল করে আছে।
(৩) যেহেতু আলফা কণাসমূহ ধনাত্মক চার্জযুক্ত এবং এক্ষেত্রে বিকর্ষিত হয়, সেহেতু পরমাণুর কেন্দ্রটিও ধনাত্মক চার্জযুক্ত হবে। তিনি ভারী ও ধনাত্মক চার্জযুক্ত পরমাণুর এ কেন্দ্রকে নিউক্লিয়াস (nucleus) নামকরণ করেন। ]
৪) আলফা কণার গতিপথের পরিবর্তন হিসাব করে দেখান যে, পরমাণুর নিউক্লিয়াসে ধনাত্মক চার্জের পরিমাণ মৌলের পারমাণবিক সংখ্যার সমান। (রাদারফোর্ড জানতেন: ৫ কণার ভর ইলেকট্রন (e) কণার ভরের চেয়ে 7000 গুণ বেশি এবং এটি দ্বিধনাত্মক চার্জযুক্ত।
(৫) পরমাণুর আকার (H পরমাণুর ব্যাস 1 x 10 cm বা, 0.1 nm) এর তুলনায় নিউক্লিয়াসের আকার (ব্যাস 1 x 10 – 10 cm) খুবই ছােট। তাই বলা যায়, পরমাণুটি এর নিউক্লিয়াস থেকে প্রায় ১০ হাজার থেকে ১ লক্ষ গুণ বড়।
রাদারফোডের পরমাণু মডেল (Rutherford’s Atom Model)
1911 খ্রিস্টাব্দে আলফা কণা পরীক্ষার সাহায্যে পরমাণুতে নিউক্লিয়াস শনাক্তকরণের মাধ্যমে রাদারফোর্ড প্রদত্ত পরমাণু মডেলটির প্রস্তাবনাসমূহ নিম্নরূপ :
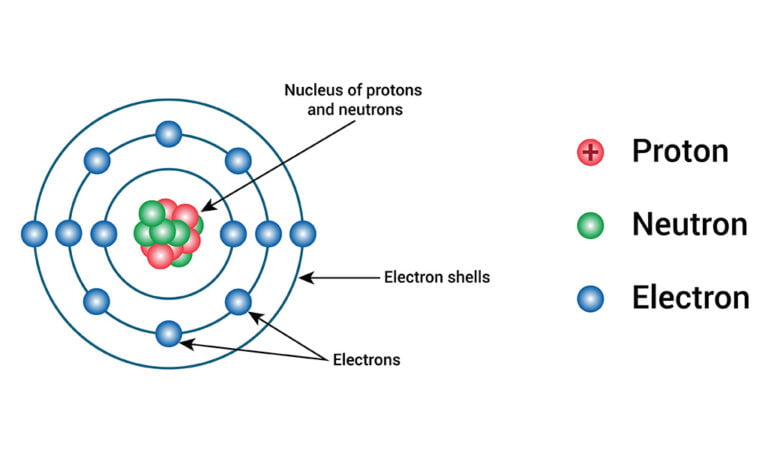
(১) গােলাকার পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউকিয়াস বলা হয়। পরমাণুর মােট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত। ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভূত।
১)পরমাণু বিদ্যুৎ নিরপেক্ষ। তাই নিউক্লিয়াসের ধনাত্মক চার্জ সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন থাকে।
(৩) সৌরজগতে সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতাে পরমাণুর ইলেকট্রনগুলাে এর কেন্দ্রস্থ নিউক্লিয়াসের চারদিকে নিজ নিজ কক্ষপথে সতত ঘূর্ণায়মান থাকে।
ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াসের ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং আবর্তনশীল ইলেকট্রনের কেন্দ্ৰবহির্মুখী বল। পরস্পর সমান অর্থাৎ পরস্পরকে সমভার করে (counter-balanced)।
রাদারফোর্ড পরমাণু মডেলে নিউক্লিয়াসের ধারণা আছে বলে একে পরমাণুর নিউক্লিয়ার মডেলও বলে। সৌরজগতের সাথে মিল রেখে মডেলটি দেয়া হয়েছে বলে একে সােলার সিস্টেম এটম মডেল (Solar system atom model)-ও বলা হয়।
রাদারফোর্ড পরমাণু মডেলের সীমাবদ্ধতা (Limitations of Rutherford’s Atom Model)
রাদারফোর্ড পরমাণু মডেলের প্রধান দিক যেমন পরমাণুর একটি নিউক্লিয়াস ও নিউক্লিয়াস বহির্ভূত ইলেকট্রন অঞ্চল আছে—তা আজ সর্বজনস্বীকৃত ও পরীক্ষা দ্বারা প্রমাণিত। কিন্তু এটির প্রধান সীমাবদ্ধতা হচ্ছে নিম্নরূপ :
১। সৌরমণ্ডলের গ্রহসমূহ সামগ্রিকভাবে চার্জবিহীন, অথচ পরমাণুতে আবর্তনশীল ইলেকট্রনসমূহ ঋণাত্মক চার্জযুক্ত এবং পরস্পরকে স্থির বৈদ্যুতিক বল দ্বারা বিকর্ষণ করে। অপরদিকে গ্রহসমূহ মহাকর্ষ বল দ্বারা পরস্পরকে আকর্ষণ করে। সুতরাং গ্রহগুলাের সাথে ইলেকট্রনের তুলনা সঠিক হয়নি।
২। ম্যাক্সওয়েলের আলাে সম্পর্কীয় তড়িৎ চুম্বকীয় তত্ত্বানুসারে কোনাে চার্জযুক্ত বস্তু বা কণা কোনাে বৃত্তাকার পথে ঘুরলে তা ক্রমাগতভাবে শক্তি বিকিরণ করবে এবং তার আবর্তনচক্রও ধীরে ধীরে কমতে থাকবে।
সুতরাং এক্ষেত্রে বিভিন্ন কক্ষপথে আবর্তনশীল ঋণাত্মক চার্জযুক্ত ইলেকট্রনসমূহ ধীরে ধীরে শক্তি হারাতে হারাতে নিউক্লিয়াসে পতিত হবে।
অর্থাৎ রাদারফোর্ডের পরমাণু মডেল সম্পূর্ণভাবে একটি অস্থায়ী অবস্থা হবে। অথচ। পরমাণু হতে ক্রমাগত শক্তি বিকিরণ বা ইলেকট্রনসমূহের নিউক্লিয়াসে পতন কখনােই ঘটে না।
৩। H-পরমাণুর বর্ণালি সম্বন্ধে কোনাে সুষ্ঠু ব্যাখ্যা এ মডেল দিতে পারে না। যেমন
ইলেকট্রন – শক্তি বিকিরণ অবিচ্ছিন্নভাবে ঘটে; তাই পরমাণুর বর্ণালিতে সৃষ্ট রেখাসমূহ অবিচ্ছিন্ন হওয়া আবর্তনশীল ইলেকট্রনের স্বাভাবিক। কিন্তু বর্ণালিতে সৃষ্ট রেখাসমূহ বিচ্ছিন্ন ও বেশ উজ্জ্বল হয়।
৪। আবর্তনশীল ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোনাে ধারণা রাদারফোর্ডের পরমাণু মডেলে দেয়া হয়নি।
৫। একাধিক ইলেকট্রনবিশিষ্ট পরমাণুতে ইলেকট্রনগুলাে নিউক্লিয়াসকে কীভাবে পরিক্রমণ করে, তার কোনাে উল্লেখ এ মডেলে নেই।
বাের পরমাণু মডেল (Bohr’s Atom Model)
পদার্থবিজ্ঞানী ম্যাক্স প্লাঙ্কের ও আইনস্টাইনের সমন্বিত আলাে সম্পর্কীয় বিকিরণ কোয়ান্টাম তত্ত্ব অনুসরণ করে ডেনমার্কের পদার্থবিজ্ঞানী নীলস বাের (Niels Bohr) 1913 খ্রিস্টাব্দে রাদারফোর্ড পরমাণু মডেলের কিছু ত্রুটি দূর করেন। তখন নীল্স বাের রাদারফোর্ডের পরীক্ষাগারে কাজ করতেন।
রাদারফোর্ড প্রদত্ত পরমাণু মডেলের ৩টি ক্রটি যেমন (i) ম্যাক্সওয়েলের তত্ত্বভিত্তিক ক্রটি, (ii) ইলেকট্রনের কক্ষপথের আকারভিত্তিক ত্রুটি এবং (iii) H পরমাণুর পারমাণবিক বর্ণালি সৃষ্টির যথার্থ ব্যাখ্যা সহকারে বিজ্ঞানী বাের তাঁর বিখ্যাত পরমাণু মডেল প্রকাশ করেন।
বাের পরমাণু মডেলের প্রস্তাবনাসমূহ নিম্নরূপ :
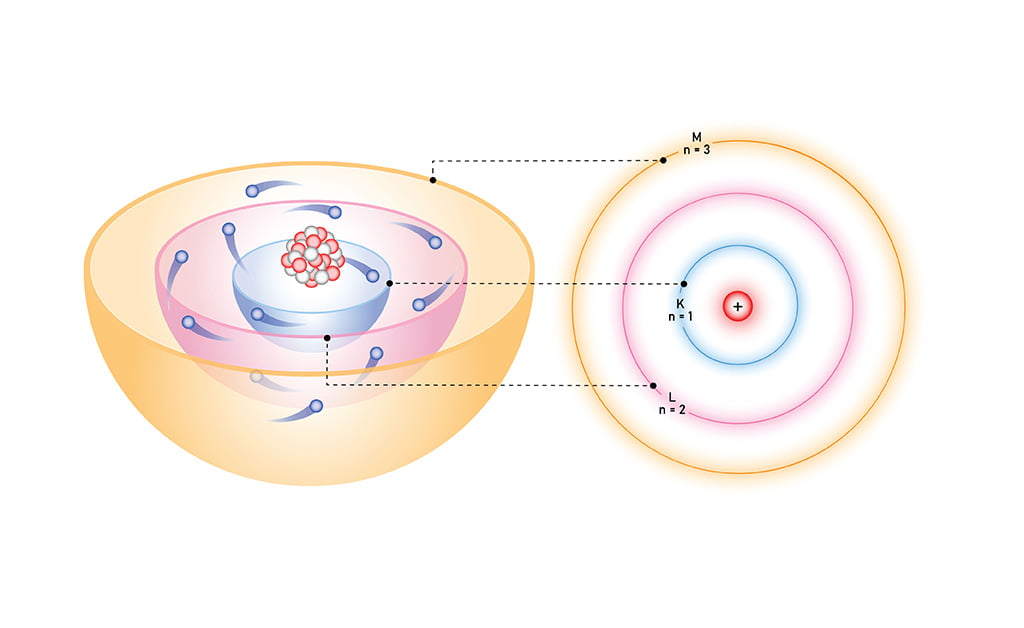
(১) ইলেকট্রনের স্থির কক্ষপথ বা শক্তিস্তরের ধারণা : পরমাণুর কেন্দ্রস্থলে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভূত; একে পরমাণুর নিউক্লিয়াস বলা হয়।
নিউক্লিয়াসকে কেন্দ্র করে কয়েকটি নির্দিষ্ট শক্তির বৃত্তাকার কক্ষপথেই ধনাত্মক চার্জের সমসংখ্যক ইলেকট্রনসমূহ নিউক্লিয়াসের চারদিকে আবর্তন করে। এ আবর্তনের সময় ইলেকট্রনের গতি সাধারণ পদার্থবিদ্যার সব নিয়ম মেনে চলে।
তবে যতক্ষণ তা একটি কক্ষে অবস্থান করবে, ততক্ষণ তা কোনাে শক্তি বিকিরণ। বা শশাষণ করবে না। এই কক্ষপথসমূহকে স্থির কক্ষপথ (stationary orbits) বা শক্তিস্তর বা অরবিট বলা হয়।
শক্তিস্তর বা কক্ষপথ নির্দেশক প্রতীক হলাে n; ১ম শক্তিস্তরের বেলায়, n = 1, ২য় শক্তিস্তরের বেলায়, n = 2 ইত্যাদি।
(২) ইলেকট্রনের কৌণিক ভরবেগের ধারণা : প্রতিটি নির্দিষ্ট কক্ষপথ বা শক্তিস্তরে আবর্তনরত ইলেকট্রনের কৌণিক ভরবেগ নির্দিষ্ট এবং তা h/2π এর অখণ্ড বা পূর্ণ সংখ্যার গুণিতক হবে।
অর্থাৎ, mvr = nh/2π
এখানে m = ইলেকট্রনের ভর, v = ইলেকট্রনের সরলরৈখিক গতিবেগ, r = কক্ষপথের ব্যাসার্ধ,v= কৌণিক বেগ, h = প্লাঙ্কের ধ্রুবক (6.626 x 10-34 J.s), n = অখণ্ড সংখ্যা অর্থাৎ 1, 2, 3, 4 প্রভৃতি পূর্ণ সংখ্যা।
n এর এসব মানের ওপর ভিত্তি করে যথাক্রমে প্রথম, দ্বিতীয়, তৃতীয় প্রভৃতি কক্ষপথ নির্দেশিত হয়।
(৩) শক্তির শােষণ বা বিকিরণ ও বর্ণালি সৃষ্টির ধারণাঃ যখন কোনাে ইলেকট্রন একটি কক্ষপথ বা শক্তিস্তর হতে অন্য শক্তিস্তর বা কক্ষপথে লাফিয়ে চলে, তখন ঐ ইলেকট্রন দ্বারা নির্দিষ্ট পরিমাণ আলােক শক্তি শােষিত বা বিকিরিত হয়।
যখন ইলেকট্রন নিম্ন শক্তিস্তর হতে উচ্চ শক্তিস্তরে লাফিয়ে চলে তখন আলোক শক্তির শােষণ এবং যখন উচ্চ শক্তিস্তর হতে নিম্ন শক্তিস্তরে নিউক্লিয়াস লাফিয়ে চলে, তখন আলােক শক্তির বিকিরণ ঘটে।
ইলেকট্রন যদি প্রথম কক্ষপথে ইলেকট্রনের শক্তি E; এবং দ্বিতীয় কক্ষপথে ইলেকট্রনের শক্তি E, হয়, তবে, কক্ষপথ বিকিরিত আলোক শক্তি হবে ΔE = E2-E1। এ শক্তি তড়িৎ চুম্বকীয় বিকিরণ হিসেবে নির্গত হবে।
বাের মডেলের সীমাবদ্ধতা (Limitations of Bohr’s Atom Model)
বাের পরমাণু মডেলের সীমাবদ্ধতাগুলাে নিম্নরূপ :
(১) বাের পরমাণু মডেল H পরমাণু ও একক ইলেকট্রনবিশিষ্ট আয়নগুলাের (যেমন He+, Li2+) বর্ণালির ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রনবিশিষ্ট পরমাণুগুলাের বর্ণালির ব্যাখ্যা করতে পারে না। |
(২) এক শক্তিস্তর হতে অপর শক্তি স্তরে ইলেকট্রনের স্থানান্তর ঘটলে, বাের পরমাণু মডেল অনুসারে একটি রেখা বর্ণালি সৃষ্টি হওয়ার কথা। উচ্চ ক্ষমতার স্পেকট্রোস্কোপ দ্বারা পরীক্ষণ করলে দেখা যায়, প্রতিটি বর্ণালি রেখা কয়েকটি সূক্ষ্ম রেখা দিয়ে গঠিত। বাের মডেল এসব সূক্ষ্ম রেখার উৎপত্তির কারণ ব্যাখ্যা করতে পারে না।
(৩) বাের মডেলে পরমাণুর আবর্তনশীল ইলেকট্রনের কক্ষপথ দ্বিমাত্রিক সমতলীয়। বাের মডেল থেকে পরমাণুর প্রকৃত ত্রিমাত্রিক কাঠামোের কোনাে ধারণা পাওয়া যায় না। |
(৪) ইলেকট্রনকে কণারূপে গণ্য করা হলে তবে একটি নির্দিষ্ট সময়ে সেই ইলেকট্রনের অবস্থান ও ভরবেগ নির্ণয় করা সম্ভব। কিন্তু হাইজেনবার্গের ‘অনিশ্চয়তা নীতি অনুযায়ী একটি নির্দিষ্ট সময়ে পরমাণুর মধ্যে কোনাে একটি ইলেকট্রনের অবস্থান ও ভরবেগ একই সঙ্গে নির্ণয় করা যায় না।
যেহেতু তাঁর মতে গতিশীল ইলেকট্রনের কণা ও তরঙ্গ উভয় ধর্ম অর্থাৎ তড়িৎ চুম্বকীয় বৈশিষ্ট্যও থাকে (ব্ৰগলির মতবাদ)।
বাের পরমাণু মডেলের সাফল্য ও গ্রহণযােগ্যতা (Achievements of Bohr’s Atom Model)
(১) পরমাণু মডেলের স্থায়িত্ব : বাের পরমাণু মডেল মতে কোনাে নির্দিষ্ট শক্তিস্তরে ইলেকট্রন আবর্তনকালে শক্তির ক্ষয় বা বিকিরণ ঘটে না। প্রথম শক্তিস্তর থেকে আর কোনাে নিম্নস্তরের শক্তি স্তর না থাকায়, ইলেকট্রন লাফ দিয়ে এর নিউক্লিয়াসে যাওয়ার সুযােগ নেই।
অর্থাৎ আবর্তনশীল ইলেকট্রনের ক্রমাগত শক্তি বিকিরণ সম্ভব না হওয়ায় বাের মডেল স্থায়িত্ব লাভ করেছে; যা দ্বারা রাদারফোর্ড মডেলের উত্তাপিত ত্রুটি দূর হয়েছে।
(২) বর্ণালির ব্যাখ্যা : বাের পরমাণু মডেল এক ইলেকট্রন বিশিষ্ট H পরমাণুর এবং আয়ন যেমন H+, Li2+, Be3+ আয়নের রেখা বর্ণালির সুষ্ঠু ব্যাখ্যা করতে সক্ষম হয়।
(৩) H-পরমাণুর ১ম কক্ষপক্ষের ব্যাসার্ধ নির্ণয় করা হয়। একে বাের ব্যাসার্ধ (ao) বলে; ao = 5.292 x 10-ll m।
(৪) বাের পরমাণু মডেলে পরমাণুর বিভিন্ন শক্তিস্তরে আবর্তনশীল ইলেকট্রনের শক্তির পরিমাণ নির্ণয় সম্ভব হয়েছে। একটি শক্তিস্তর হতে অন্য শক্তিস্তরে একটি ইলেকট্রন লম্ফ দিয়ে স্থানান্তরিত হলে কী পরিমাণ শক্তি শােষিত বা বিকিরিত হবে তা
রাদারফোর্ড পরমাণু মডেল ও বাের পরমাণু মডেলের মধ্যে তুলনা (Comparison between Rutherford’s Atom Model and Bohr’s Atom Model)
উভয় পরমাণু মডেলের উপস্থাপনের মূল ধারণাসমূহ :
১। পরমাণু মডেলের ভিত্তি : রাদারফোর্ডের পরমাণু মডেলের ভিত্তি হলাে রাদারফোর্ড কর্তৃক সম্পাদিত আলফা (৫) কণা বিচ্ছুরণ পরীক্ষার পর্যবেক্ষণ নির্ভর সিদ্ধান্তসমূহ।
রাদারফোর্ড পরমাণু মডেলে পরমাণুর কেন্দ্রে ধনাত্মক চার্জযুক্ত নিউক্লিয়াস থাকে এবং ধনাত্মক চার্জের সমসংখ্যক ঋণাত্মক ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে সতত আবর্তনশীল থাকে। রাদারফোর্ড মডেলে রয়েছে সৌরজগতের বিন্যাস প্রকরণ।
অপরদিকে,বাের পরমাণু মডেলের ভিত্তি হলাে রাদারফোর্ড পরমাণু মডেলের পরমাণুর কেন্দ্রস্থ নিউক্লিয়াস ও নিউক্লিয়াস বহির্ভূত ইলেক্ট্রন অঞ্চলের সাথে ম্যাক্স প্লাঙ্ক ও আইনস্টাইনের আলােক সম্পর্কীয় বিকিরণের কোয়ান্টাম তত্ত্বের সমন্বয়।
২। আবর্তনশীল ইলেকট্রনের কক্ষপথের ধারণা : রাদারফোর্ডের পরমাণু মডেলে ইলেকট্রনের কক্ষপথের আকার ও সংখ্যাকে সুস্পষ্ট করা হয়নি। এতে শুধু বলা হয়েছে নিউক্লিয়াসকে কেন্দ্র করে যে কোনাে ব্যাসার্ধের বৃত্তাকার কক্ষপথে ইলেকট্রনগুলাে গ্রহের মতাে আবর্তন করতে পারে। অপরদিকে,
বাের পরমাণুতে প্রতিটি ইলেকট্রন কয়েকটি নির্দিষ্ট মানের ব্যাসার্ধের বৃত্তাকার স্থায়ী কক্ষপথে নিউক্লিয়াসকে আবর্তন করে থাকে। এ সব নির্দিষ্ট ও স্থায়ী কক্ষপথগুলাে নির্দিষ্ট বিভিন্ন মানের শক্তিযুক্ত এবং এসব স্থায়ী কক্ষপথে আবর্তনশীল ইলেকট্রনও সমশক্তিসম্পন্ন হয়ে থাকে।
৩। পরমাণু মডেলের স্থায়িত্ব : রাদারফোর্ডের পরমাণু মডেলের স্থায়িত্বের কারণ দেখানাে হয়েছে ধনাত্মক চার্জযুক্ত কেন্দ্রস্থ নিউক্লিয়াস ও ঋণাত্মক চার্জযুক্ত ইলেকট্রনের মধ্যস্থ স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং আবর্তনশীল ইলেকট্রনের কেন্দ্ৰবহির্মুখী বলদ্বয়ের লব্ধিফল। অপরদিকে,
বাের পরমাণু মডেলের স্থায়িত্বের কারণ দেখানাে হয়েছে পরমাণুর নিউক্লিয়াসের প্রভাবে সৃষ্ট নির্দিষ্ট সংখ্যক শক্তিস্তরে ইলেকট্রনের অবস্থান এবং শক্তি বিকিরণ ছাড়া ঐ সব স্থির শক্তির কক্ষপথে সতত সমশক্তিতে আবর্তন।